Принцип Ле Шателье: "Если на систему, находящуюся в равновесии, оказать воздействие, то в результате протекающих процессов равновесие сместится в таком направлении, чтобы оказанное воздействие уменьшилось".
Нарушить равновесие можно тремя способами:
- изменив концентрацию вещества;
- изменив температуру;
- изменив давление.
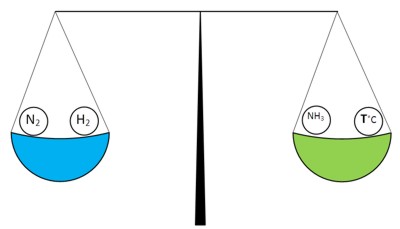
Когда реакция синтеза аммиака находится в равновесии, то это можно изобразить так (реакция экзотермическая):
N2 (г) + 3H2 (г) → 2NH3 (г) + Теплота
Меняем концентрацию
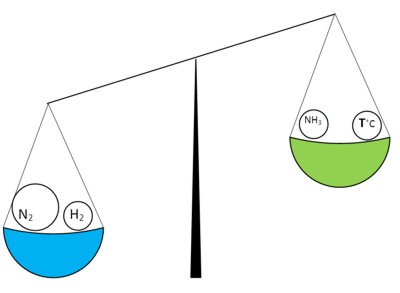
Введем дополнительное количество азота в сбалансированную систему. При этом баланс нарушится:
Прямая реакция начнет протекать быстрее, поскольку количество азота увеличилось и он вступает в реакцию в большем количестве.
Через некоторое время снова наступит химическое равновесие, но при этом концентрация азота будет больше, чем концентрация водорода:
Но, осуществить "перекос" системы в левую часть можно и другим способом - "облегчив" правую часть, например, отводить аммиак из системы по мере его образования.
Таким образом, снова будет преобладать прямая реакция образования аммиака.
Меняем температуру
Правую сторону наших "весов" можно изменять путем изменения температуры. Для того, чтобы левая часть "перевесила", необходимо "облегчить" правую часть - уменьшить температуру:
Нарушить равновесие в системе при помощи давления можно только в реакциях с газами. Увеличить давление можно двумя способами:
- уменьшением объема системы;
- введением инертного газа.
При увеличении давления количество столкновений молекул возрастает. При этом повышается концентрация газов в системе и изменяются скорости прямой и обратной реакций - равновесие нарушается. Чтобы восстановить равновесие система "пытается" уменьшить давление.
Во время синтеза аммиака из 4-х молекул азота и водорода образуется две молекулы аммиака. В итоге количество молекул газов уменьшается - давление падает. Как следствие, чтобы придти к равновесию после увеличения давления, скорость прямой реакции возрастает.
Подведем итог.
Согласно принципу Ле Шателье увеличить производство аммиака можно:
- увеличивая концентрацию реагентов;
- уменьшая концентрацию продуктов реакции;
- уменьшая температуру реакции;
- увеличивая давление при котором происходит реакция.
Комментариев нет:
Отправить комментарий