Задание. Распределить вещества по классам.
Химия школьникам
Этот блог, для обучающихся химии МБОУ "СОШ 54". В первую очередь, для тех кто пропустил уроки по какой-либо причине. А так же для тех, у кого есть какие-то проблемы с пониманием изучаемого материала, вопросы или просто интересна химия. И, конечно, приглашаю родителей школьников.
11 класс. Ориентация спинов
Взаимная ориентация спинов оказывается решающим фактором при образовании молекулы водорода. Химическая связь возникает только в том случае, когда коллективизируемые электроны имеют противоположно направленные спины. При столкновении атомов водорода с параллельными спинами электроны также коллективизируются на некоторое время, но стабильных состояний не возникает. Коллективизация в этом случае приводит к появлению сил отталкивания независимо от расстояний между ядрами.
Дело в том, что взаимная ориентация спинов определяет, согласно квантовой механике, характер движения электронов. При антипараллельных спинах электроны проводят сравнительно большое время между ядрами, так что средняя плотность отрицательного заряда оказывается достаточной для компенсации отталкивания ядер. При параллельных спинах эта плотность мала, и происходит отталкивание.
Электроны с одинаково ориентированными спинами не могут разом втиснуться в промежуток между ядрами, как если бы это были два головастика, пытающихся одновременно, голова к голове, пролезть в узкую щель. Межъядерное пространстве доступно для электронов с противоположно направленными спинами, равно как узкая щель — «антипараллельным» головастикам. Но, конечно, кроме одинакового конечного результата здесь нет абсолютно ничего общего. Электрон не головастик и никакие сравнения, никакие ссылки на известные факты классической физики не помогут понять (если оставаться на позициях классики), почему ориентация спинов так существенно влияет на движение электронов: весь эффект чисто квантовый.
Итак, связывающие состояния образует пара электронов, имеющих антипараллельные спины.
Теперь все необходимое для объяснения насыщения и валентности налицо. Начнем с простого. Почему молекула водорода Н2 не может присоединить к себе еще один атом? Почему бы, например, сразу трем электронам не связать все три ядра?
Это запрещено принципом Паули. Коллективизированные электроны находятся в одном и том же квантовом состоянии и поэтому обязаны отличаться ориентацией спинов. Но возможны лишь две ориентации! Поэтому двум электронам с антипараллельными спинами разрешается осуществлять связь, но третий здесь оказывается абсолютно лишним.
После того как молекула водорода образована, она всегда будет отталкивать водородные атомы. Этим и объясняется насыщение.
Вот еще на что здесь нужно обратить внимание. Каждый из водородных атомов, сливающихся в молекулу, имеет по одному электрону с произвольно ориентированным спином. Молекула водорода имеет пару электронов с антипараллельными спинами и не присоединяет к себе новых атомов.
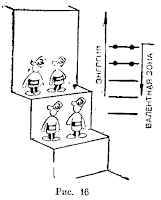
Этот факт имеет совершенно общее значение. Электроны, образующие пары с антипараллельными спинами, в каждом из атомов не принимают участия в химической связи. Эту связь могут осуществлять лишь электроны со свободными спинами. Во внутренних целиком заполненных оболочках электроны всегда образуют пары и не участвуют в химической связи. Такой же характер имеют внешние оболочки благородных газов, которые по этой причине в невозбужденном состоянии совершенно не активны химически. Лишь в том случае, если внешняя оболочка атома не заполнена целиком, ее электроны могут создавать химическую связь.
Но не все электроны! Число электронов, обладающих «свободными» спинами, а следовательно и валентность атома, равно либо числу внешних электронов, не входящих в замкнутые оболочки, либо же числу электронов, недостающих до завершения оболочки, в зависимости от того, какое из этих чисел меньше.
Таким образом, несмотря на ничтожную в макроскопических масштабах величину, спин электрона определяет всю «химию» атомов. Протекая в больших масштабах, химические реакции, начиная от простого горения и кончая сложнейшими превращениями внутри живого организма, вызывают изменения в мире, преобразующие весь его облик.
Подписаться на:
Сообщения (Atom)